四川疫苗熱原檢測
來源:
發布時間:2025-10-07
熱原是能引發恒溫動物體溫異常升高的物質總稱,主要成分為細菌內毒素(革蘭氏陰性菌脂多糖 LPS),同時涵蓋病毒、真菌毒素、支原體等非內毒素熱原,其檢測是保障藥品與醫療器械安全性的關鍵環節。當前熱原檢測已形成 “特異性檢測 + 廣譜篩查” 互補的完整體系:以鱟試驗法(含天然 LAL 與重組 rCR/rFC 試劑)作為細菌內毒素的特異性檢測手段,憑借 fg 級靈敏度成為制藥行業常規質控方法,可通過凝膠法實現定性、動態濁度 / 顯色法完成定量;以家兔熱原試驗作為傳統廣譜篩查方法,雖操作繁瑣(需預試篩選基礎體溫穩定家兔,正式試驗觀察 3 小時體溫變化),但仍是放射性質的藥物、血液制品等高風險產品排除非內毒素熱原的補充手段;以單核細胞活化反應測定(MAT)作為新興全熱原檢測技術,利用人源單核細胞(如 THP-1 細胞)釋放 IL-6、TNF-α 等細胞因子的特性,可同時識別內毒素與非內毒素熱原,契合疫苗、基因治療產品等對風險控制的需求。三種方法協同應用,從原料入廠到成品放行構建全流程熱原防控網絡,既保證對內毒素的準確監控,又避免非內毒素熱原的遺漏風險。
熱原檢測技術百年演進,關鍵驅動力是靈敏度、速度與動物福利的平衡。四川疫苗熱原檢測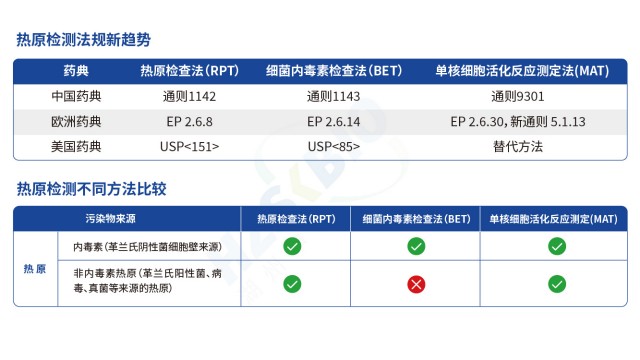
在 MAT 法熱原檢測中,PBMC(外周血單核細胞)與單核細胞系各有優劣,單核細胞系更適合標準化檢測。PBMC 的優勢在于免疫細胞成分豐富(含單核細胞、淋巴細胞等),對熱原反應敏感,靈敏度相對較高;但局限同樣明顯 ——PBMC 需從不同供體獲取,供體免疫狀態差異會導致檢測結果不穩定,且無法長期保存,難以建立標準化方法學。單核細胞系(如 HL-60、MM6、THP1)則克服了 PBMC 的局限:細胞來源穩定(可批量培養),TLR 受體表達覆蓋主要亞型(如 HL-60 表達 TLR1-TLR9),對熱原反應重復性好,更適合商業化試劑盒與法規檢測。不同單核細胞系性能也有差異:MM6/IL-6 法檢測限約 0.05EU/mL,THP1/TNF-α 法因 TNF-α 為一級免疫效應物檢測限更低,但 TNF-α 穩定性差;HL-60/IL-6 法檢測限與穩定性均優于前兩者,成為主流選擇。湖州申科生物MAT試劑盒選用 HL-60 細胞系,正是基于其優異的穩定性與熱原響應適配多場景,確保不同批次檢測結果一致。
疫苗熱原檢測風險評估湖州申科熱原檢測試劑盒聯合了國內相關機構室間驗證,與傳統RPT法結果高度一致,符合法規要求。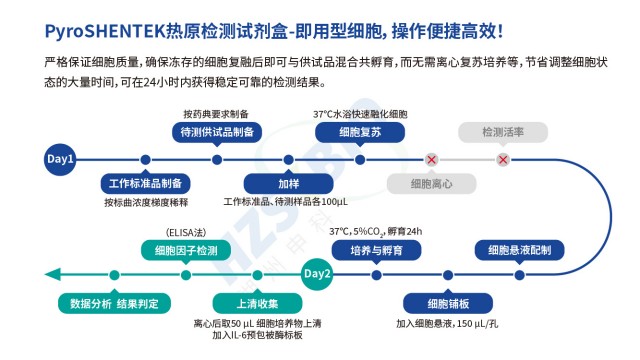
在單核細胞活化試驗(MAT)的熱原檢測中,IL-6 被確定為關鍵檢測指標,而非 IL-1β 或 TNF-α,主要源于其在穩定性、生物學關聯性及商業化應用上的優勢。從穩定性來看,IL-6 在體外培養環境中受個體免疫狀態影響較小,半衰期更長,實驗重復性更優,且檢測靈敏度高,能準確定量熱原污染水平;而 TNF-α 和 IL-1β 產生時間短、表達量低,還易被蛋白酶降解,導致檢測信號波動大,難以標準化。從生物學特性而言,IL-6 是先天免疫反應的炎癥介質,可通過活化 JAK-STAT 和 NF-κB 通路驅動急性期反應,如誘導大腦產生前列腺素 E2(PGE2)觸發發熱,與熱原的致熱機制直接關聯,是公認的發熱標志物。同時,MAT 法熱原檢測會輔以 IL-1β 和 TNF-α 監測 ——IL-1β 反映單核細胞活化程度,TNF-α 提示炎癥放大效應,形成多因子協同體系。此外,IL-6 的 ELISA 試劑盒市場成熟度高、跨平臺兼容性強,而 IL-1β 和 TNF-α 的檢測方法在靈敏度和標準化上仍有局限,進一步奠定了 IL-6 的重要地位。
MAT 法熱原檢測標曲采用非倍比稀釋,而非 1-0.5-0.25 的倍比稀釋,主要優勢在于提升標曲準確性與適用性,避免稀釋誤差影響。一是可密集覆蓋關鍵濃度區間:熱原檢測的重點關注區為低濃度拐點(如 0.0125-0.1EU/mL)與高濃度平臺區(如 0.5-1EU/mL),非倍比稀釋可在這些區間設置更多濃度點(如 0.0125、0.025、0.05、0.1、0.25、0.5、1EU/mL),提升曲線擬合精度,而倍比稀釋低濃度點少,易導致低濃度熱原定量不準。二是降低稀釋誤差累積:倍比稀釋需連續稀釋(如 1EU/mL→0.5EU/mL→0.25EU/mL),每一步誤差會累積,導致低濃度點實際濃度偏離理論值;非倍比稀釋通過單獨配制每個濃度點(如直接用標準品配制 0.025EU/mL),避免誤差累積,提升標曲可靠性。三是適配不同樣品濃度:非倍比稀釋可根據樣品預期濃度調整標曲范圍,如樣品預期濃度 0.05EU/mL,可增加 0.025、0.05、0.1EU/mL 點,確保樣品濃度落在標曲線性區,而倍比稀釋范圍固定,靈活性差。這些優勢使非倍比稀釋成為 MAT 法標曲配制的優先選擇方式。
2023年PRIMM研究:聚山梨酯80 mRNA疫苗中,家兔法熱原檢查因LER漏檢41%,MAT回收率98%+。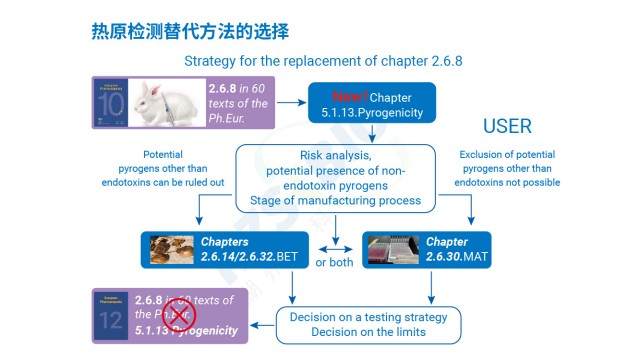
PBMC(外周血單個核細胞)的供體差異會直接導致熱原檢測結果的波動,主要體現在 IL-6 釋放水平的不一致。不同供體的 PBMC,其單核細胞比例、TLR 受體表達量、免疫活性狀態存在差異:有的供體 PBMC 受熱原刺激后, IL-6 釋放量高;有的則極低,甚至無明顯響應。實驗數據顯示, PBMC 的標曲各濃度點相對偏差有高達 171.43%的,正是這種差異的體現,導致熱原檢測結果難以標準化,無法準確判斷供試品熱原是否超標,從而增加了藥品的質量控制風險。
中國藥典9301已將MAT列為熱原檢測的補充方法,美國藥典鼓勵企業采用經過驗證的MAT替代家兔法。江蘇原料藥熱原檢測結果判定MAT熱原檢測通過熱原活化單核細胞釋放促炎細胞因子,再經ELISA定量 IL-6判斷供試品是否合格。四川疫苗熱原檢測
MAT 法熱原檢測的關鍵機制是 “熱原活化單核細胞 TLR 受體,觸發炎癥因子分泌”,TLR 受體的全覆蓋是保障檢測無遺漏的關鍵。不同熱原需活化不同 TLR 受體:最常見的內毒素(LPS)主要活化 TLR4,而革蘭氏陽性菌的非內毒素熱原(如脂磷壁酸)需活化 TLR2/6,真菌多糖活化?TLR2/4,病毒核酸活化 TLR3/7/8 等。因此,MAT 試劑盒配套細胞需具備全覆蓋的 TLR 受體表達—湖州申科生物通過 Western blot 驗證,其 HL-60 細胞系表達 TLR1-TLR9,可響應各類熱原。為進一步驗證覆蓋能力,申科用不同非內毒素熱原配體(如脂磷壁酸、酵母多糖)刺激細胞,結果顯示所有配體均能誘導 IL-6 分泌,且呈良好量效關系,證明試劑盒可檢出各類熱原。若細胞 TLR 受體覆蓋不全(如缺失 TLR2),則無法檢測革蘭氏陽性菌的非內毒素熱原,導致漏檢風險,因此 TLR 受體的全覆蓋是 MAT 法熱原檢測的關鍵技術指標之一。
四川疫苗熱原檢測
上一篇
上海原料藥熱原檢測家兔法替代方案
下一篇:
江蘇血液制品內毒素檢測鱟試劑
相關新聞
- 山西熱原檢測規范 2025-10-12
- 江蘇合規性內毒素檢測凝膠法鱟試劑 2025-10-12
- 江蘇抗體藥物熱原檢測操作步驟 2025-10-12
- 浙江重組蛋白內毒素檢測合規申報 2025-10-12
- 廣東Human宿主細胞殘留DNA檢測生產企業 2025-10-12
- 北京熱原檢測風險評估 2025-10-12
- 成都單抗藥物用宿主細胞蛋白(HCP)殘留檢測抗體覆蓋率驗證 2025-10-12
- 遼寧熱原檢測結果判定 2025-10-12
- 重組蛋白用宿主細胞蛋白(HCP)殘留檢測方法對比 2025-10-12
- 江蘇非動物源內毒素檢測商業化試劑盒 2025-10-12
推薦新聞
- 奉賢區附近醫療軟件規劃 2025-10-12
- 江西骨科用電動手術臺成交價 2025-10-12
- 湖南高分子材料纖維加工 2025-10-12
- 浦東新區在線教育軟件規劃 2025-10-12
- 無錫評估益生菌的潛在功能益生菌功效檢測廠家有哪些 2025-10-12
- 南昌高分子生物仿生涂層效果 2025-10-12
- 沈陽框式助行器 2025-10-12
- 無錫通用試劑哪里有賣的 2025-10-12
- 浦東新區質量實驗儀器工廠直銷 2025-10-12
- 東北樹脂牙顏色 2025-10-12