寧波NDAeCTD軟件
PDF工具箱批量處理與格式修復支持PDF合并、拆分、提取頁面、旋轉頁面等操作,可批量修復字體未嵌入、超鏈接錯誤等問題,確保文件符合注冊法規要求。智能書簽與超鏈接管理提供書簽導入/導出、超鏈接自動生成(支持關鍵字搜索鏈接)、題注超鏈接拖拽式編輯等功能,簡化復雜文檔的導航設計。文檔轉換與OCR識別支持Word轉PDF(自動生成書簽、嵌入字體),以及PDF與Word、Excel等格式互轉,集成OCR功能用于掃描件文字識別。合規性驗證自動驗證PDF的頁面布局、頁碼連續性、空白頁、目錄層級等屬性,并具體錯誤位置,減少人工檢查成本。安全與協作功能支持文檔加密、數字簽名、云端同步及多設備共享,滿足企業級文件安全管理需求。加拿大DMF注冊申報關技術支持。寧波NDAeCTD軟件
歐盟eCTD的歷史沿革與強制實施 歐盟自2003年逐步推進eCTD(電子通用技術文檔)的標準化進程,初要求藥注冊申請(MAA)采用CTD格式。2010年,集中審評程序(CP)率先強制使用eCTD,隨后分散程序(DCP)和互認程序(MRP)分別于2015年、2017年跟進。至2019年,歐盟要求所有國家程序(NP)的注冊申請均以eCTD格式提交,標志著其電子遞交體系的成熟。2024年,EMA啟動eCTD4.0試點項目,旨在提升技術兼容性與審評效率。 eCTD驗證標準的迭代與關鍵更 歐盟的驗證標準歷經多次調整,例如2025年3月啟用的eCTD3.1區域模板和驗證規則v8.1,對文件結構、元數據和內容完整性提出更嚴格的要求。標準引入的“追蹤表(Tracking Table)”強制校驗規則(如15.11和15.12)曾導致CEP(歐洲藥典適用性證書)遞交,后通過允許占位文件臨時解決。與早期版本相比,v8.1強化了對模塊一區域信息的邏輯驗證,并細化了對PDF書簽、超鏈接的規范性檢查。徐匯區CDE eCTD哪個品牌好瑞士ANDA注冊申報相關技術支持。
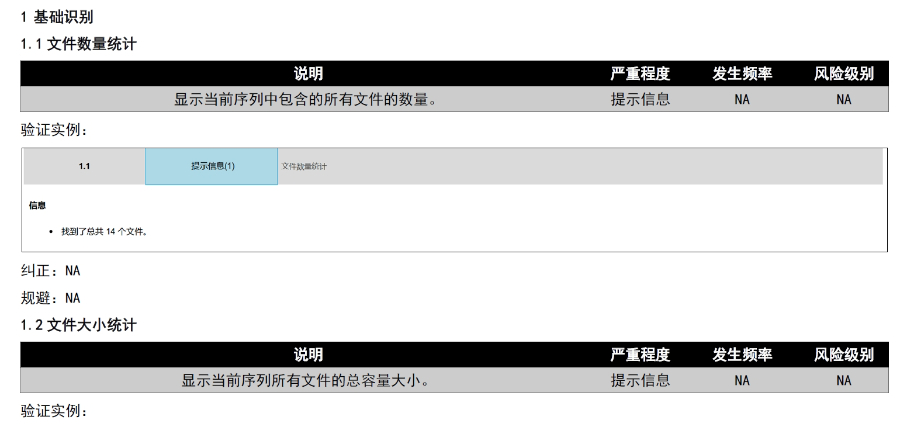
eCTD文件制作需遵循嚴格的法規要求和標準化流程,以下是關鍵要點整理:eCTD采用模塊化結構,包含模塊1(行政信息)至模塊5(臨床報告),需按ICH和監機構要求構建目錄樹。顆粒度選擇:文件提交層級需在***申報時確定并沿用,例如原料和制劑的章節(如、)需按比較低顆粒度拆分,輔料單獨成章。PDF需添加書簽(導航目錄)和超鏈接(跨網頁跳轉),超過5頁的文件必須包含目錄(TOC/LOT/LOF)。技術參數:初始視圖需設置默認縮放級別和頁面布局,書簽展開層級不超過三級,單文件大小需符合申報系統限制。驗證工具:使用軟件(如BXeCTD)自動生成書簽和超鏈接,并通過序列校驗和PDF校驗功能確保合規性。
歐洲YAO品管理局:集中審評程序由歐洲YAO品管理局(EuropeanMedicinesAgency,EMA)負責協調。人用YAO品委YUAN會:人用YAO品委YUAN會(CommitteeforMedicinalProductsforHumanUse,CHMP)負責提供科學意見。歐盟委員會:CHMP的意見隨后被提交給歐盟委YUAN會(EuropeanCommission,EC),由歐盟委會做出是否授權的終決定。這個決定在整個歐盟都是具有法律約束力的。審批過程:申請人向EMA提交申請,包括eCTD(電子通用技術文檔)格式的YAO品注冊文檔。EMA的CHMP分配一個科學評估團隊(Rapporteur和Co-Rapporteur),負責初步評估。CHMP基于評估團隊的報告提供科學意見。歐盟委會根據CHMP的意見做出終決定,批準或拒絕YAO品上市。授權范圍如果YAO品獲得批準,將獲得在整個歐盟、冰島、列支敦士登和挪威YOU效的上市許可(CentralMarketingAuthorisation,CMA)。 eCTD驗證實踐手冊相關技術支持。

eCTD的實施為監管機構和企業帶來了多重機遇。電子化申報資料能夠極大地加速審評效率,減少人為判斷錯誤和數據混淆的情況,從而提高審評的準確性和速度。同時,eCTD帶來的數據標準化機遇使得全球監管機構的資料內容和電子格式得以統一,有助于在不同監管機構之間進行數據傳輸和共享。這對于提升全球監管效率和行業研發效率具有重要意義。此外,eCTD的實施還促進了全球合作,構建了全球監管的底層大數據基礎。對于企業而言,eCTD提供了一個規范化的研發活動模板,有助于降低與監管機構溝通的成本,提高申報效率。特別是對于國內的醫技術企業而言,eCTD的實施更是具有重要意義,有助于這些企業更好地走向全球市場。然而,中小企業在享受這些機遇的同時,也面臨著技術和成本壓力。eCTD的實施需要專門的團隊進行系統維護和開發,這對于中小企業來說是一筆不小的開支。同時,數據安全問題也是企業關注的焦點。此次CDE擴大eCTD實施范圍對行業而言是一個積極的風向標。短期內,企業面臨的挑戰包括適應更高要求的技術規范并提高文件質量、和eCTD出版系統的磨合以及進行eCTD知識的跨職能培訓等。 加拿大eCTD申報相關技術支持。歐盟eCTD服務商
加拿大NDA注冊申報相關技術支持。寧波NDAeCTD軟件
2015年發布《關于藥品醫療器械審評審批制度的意見》,提出藥監五大目標,將eCTD納入國家藥監數字化戰略。2017年,中國加入ICH(國際人用藥品注冊技術協調會),成為全球第八個監管機構成員,加速與國際標準接軌。2018年,國家藥監局(NMPA)完成eCTD文檔管理系統招標,由上海寶信與德國LORENZ合作搭建技術平臺,標志著技術基礎設施的落地。 ?規范制定與試點階段(2019-2023年)? 2019-2020年,CDE(藥品審評中心)發布《eCTD技術規范》《驗證標準》等征求意見稿,并組織兩輪企業測試。2021年,NMPA明確化學藥1類、5.1類及生物制品1類上市申請適用eCTD。2022年實施電子申報(非eCTD格式),2023年取消紙質資料提交,為eCTD鋪開奠定基礎。 ?實施與擴展階段(2024-2025年)? 2024年3月更電子申報技術要求,7月啟動網絡傳輸試點。2025年1月27日,NMPA將eCTD適用范圍擴大至化藥1-5類臨床試驗及上市申請、生物制品1-3類全流程,覆蓋藥、仿制藥及生物類似藥,實現與國際主流申報模式同步。寧波NDAeCTD軟件
- 蘇州eCTD醫療科技 2025-09-22
- 無錫電子申報eCTD性價比高 2025-09-22
- 寧波生物制品eCTD服務放心可靠 2025-09-22
- 合肥INDeCTD服務放心可靠 2025-09-22
- 楊浦區國際注冊eCTD服務商 2025-09-22
- 工業園區藥品注冊eCTD哪家好 2025-09-22
- 上海藥品注冊eCTD遞交 2025-09-22
- 寧波國內注冊eCTD常用解決方案 2025-09-22
- 閔行區生物制品eCTD使用 2025-09-22
- 新藥eCTD服務價格 2025-09-22
- 陜西智能化設備管理系統平臺 2025-10-13
- 浙江貿易TFT 2025-10-13
- 四川廣告服務行業標準 2025-10-13
- 云南超頻服務器廠家供應 2025-10-13
- 四川一站式網絡營銷方案定制 2025-10-13
- 吉林操作性能好會員卡打印機口碑推薦 2025-10-13
- 南京手動游戲開發技術指導 2025-10-13
- 四川渦輪散熱風扇價格 2025-10-13
- 宿遷碳化硅半導體晶圓切割測試 2025-10-13
- 中國臺灣抓取力控系統優點 2025-10-13