高新區(qū)藥品注冊eCTD性價比
eCTD在歐盟藥品監(jiān)管中的歷史背景:歐盟eCTD(電子通用技術(shù)文檔)的發(fā)展始于對臨床試驗和藥品審評流程標(biāo)準(zhǔn)化的需求。2001年,歐盟引入《臨床試驗指令》(CTD)作為統(tǒng)一的法律框架,但其分散的成員國申報機制導(dǎo)致效率低下。2014年,歐盟通過《臨床試驗法規(guī)》(CTR, Regulation EU No. 536/2014),要求通過CTIS平臺(臨床試驗信息系統(tǒng))集中提交臨床試驗申請(CTA),并逐步推動eCTD作為電子化申報的工具。這一旨在解決傳統(tǒng)CTD模式下審評周期長、多國協(xié)調(diào)成本高的問題,為eCTD的實施奠定了基礎(chǔ)。加拿大eCTD注冊外包相關(guān)技術(shù)支持。高新區(qū)藥品注冊eCTD性價比
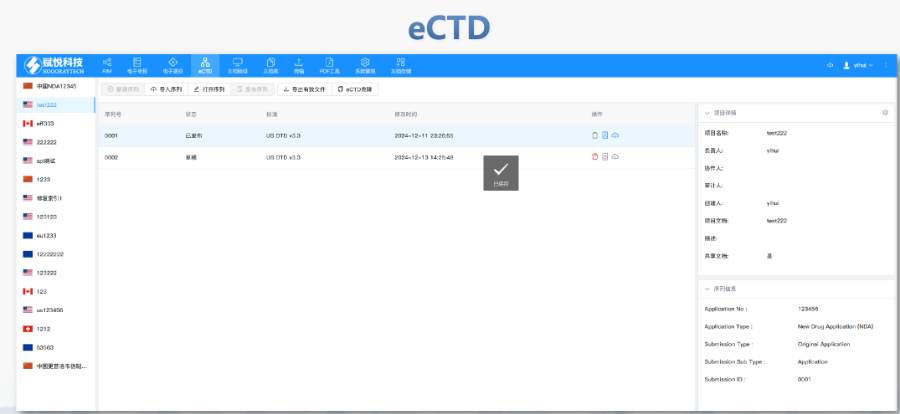
美國eCTD驗證采用三級分類:“錯誤”(必須修正)、“警告”(建議修正)、“提示信息”(參考)。例如,PDF文件版本不符或加密保護屬于“錯誤”,而書簽路徑非相對性則可能列為“警告”。驗證失敗將直接導(dǎo)致退審,企業(yè)需通過LORENZ Validator等工具預(yù)檢,確保提交前合規(guī)。 技術(shù)驗證點 驗證涵蓋XML結(jié)構(gòu)合規(guī)性、文件命名規(guī)則、生命周期管理(如序列號連續(xù)性)及PDF屬性(如字體嵌入、可搜索性)。臨床試驗數(shù)據(jù)需額外滿足CDISC標(biāo)準(zhǔn),包括SDTM和ADaM數(shù)據(jù)集的結(jié)構(gòu)驗證合肥ANDAeCTD注冊系統(tǒng)瑞士NDA注冊申報相關(guān)技術(shù)支持。
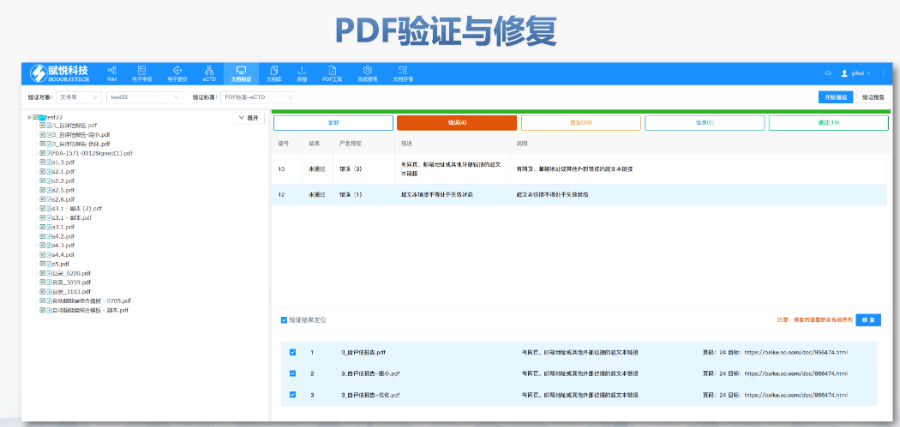
電子遞交的合規(guī)性與FENG險管理歐盟要求申請人確保電子資料與紙質(zhì)版本完全一致,若未在規(guī)定時間提交紙質(zhì)文件可能導(dǎo)致注冊終止。驗證過程中,“錯誤”級別問題(如文件命名不規(guī)范、XML邏輯錯誤)必須修正,而“警告”和“提示信息”則建議優(yōu)化以提升審評體驗。EDQM和EMA均提供驗證工具,申請人需在遞交前完成內(nèi)部預(yù)驗證。G方費用結(jié)構(gòu)與支付流程歐盟eCTD遞交費用因?qū)徳u程序類型而異:集中程序費用較高,涵蓋科學(xué)評估和合規(guī)審查成本;G家程序費用由各成員國自行設(shè)定。CEP申請需向EDQM支付評審費,具體金額根據(jù)原料YAO類型和變更復(fù)雜度分級。繳費需通過G方指定渠道完成,并附上付款憑證作為模塊1的組成部分。多語言支持與翻譯要求盡管歐盟允許使用英語提交,但部分成員國要求模塊一的行政文件翻譯為本地語言。臨床試驗數(shù)據(jù)庫(如SDTM和ADaM)需以英語呈現(xiàn),同時提供雙語標(biāo)簽以支持多國審閱。Z業(yè)翻譯服務(wù)在確保技術(shù)術(shù)語準(zhǔn)確性方面至關(guān)重要,尤其針對復(fù)雜YAO學(xué)和非臨床數(shù)據(jù)。
2020年暴發(fā)后,F(xiàn)DA進一步推動電子化進程,例如允許遠程電子簽章和臨時放寬部分格式要求,但驗證標(biāo)準(zhǔn)(如PDF版本、書簽鏈接有效性)并未降低。這一時期的實踐為eCTD在緊急審批中的靈活性提供了案例,也凸顯了其作為危機應(yīng)對工具的價值。 盡管美國尚未部署eCTD V4.0,但其技術(shù)方向已明確:支持醫(yī)療器械和保健品申報、增強數(shù)據(jù)可復(fù)用性、優(yōu)化審評系統(tǒng)與人工智能的集成。此外,區(qū)塊鏈技術(shù)在電子簽章和數(shù)據(jù)溯源中的應(yīng)用探索,可能成為下一階段升級的重點。加拿大NDA注冊申報相關(guān)技術(shù)支持。
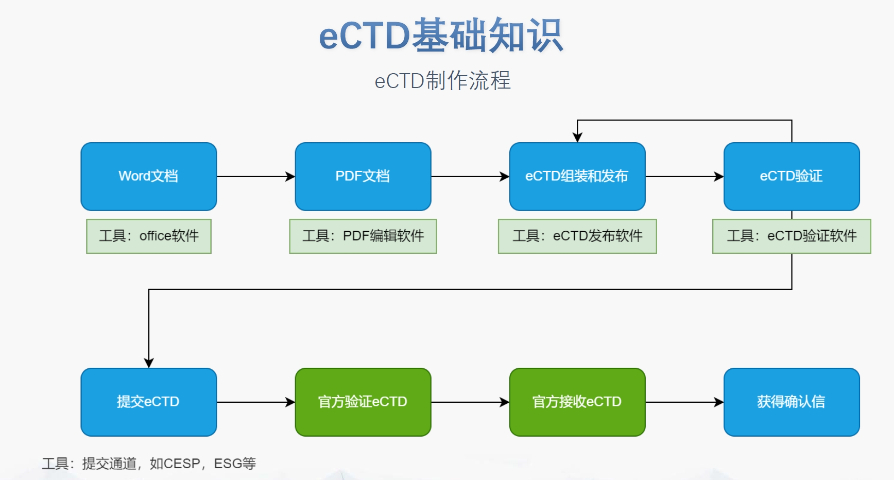
生命周期管理與變更遞交eCTD支持全生命周期管理,申請人需通過序列更(Sequence)反映yao品變更信息。例如CEP的更需提交“變更說明表”,對比已批準(zhǔn)和擬修改內(nèi)容,并附修訂版技術(shù)文檔。重大變更(如生產(chǎn)工藝調(diào)整)可能觸發(fā)GMP現(xiàn)場檢查,EDQM將根據(jù)feng險評估決定是否啟動核查。電子簽名與法律效力歐盟接受符合《電子簽名法》的數(shù)字簽名,手寫簽名的掃描件需嵌入PDF并加密保護。模塊1的申請表和承諾書必須包含you效簽名,且XML文件需通過MD5校驗確保完整性。若使用第三方簽署工具,需提前向監(jiān)管機構(gòu)報備并獲取技術(shù)認(rèn)可。中小企業(yè)支持與資源獲取EMA和EDQM為中小企業(yè)提供eCTD實施指南、驗證工具及培訓(xùn)研討會。例如,EDQM官網(wǎng)發(fā)布CEP遞交模板和案例庫,EMA則定期更Q&A文檔以解答常見問題。此外,歐盟設(shè)立專項基金,資助中小企業(yè)完成eCTD轉(zhuǎn)換和系統(tǒng)部署。 瑞士eCTD注冊外包相關(guān)技術(shù)支持。蘇州仿制藥eCTD文件如何制作
加拿大eCTD申報相關(guān)技術(shù)支持。高新區(qū)藥品注冊eCTD性價比
GDUFAIII框架與費用分類2022年更的GDUFAIII將費用分為ANDA申請費、DMF認(rèn)證費、項目費及設(shè)施費四類,實施周期至2027年。2025財年ANDA費用長至約22萬美元,較2024年增幅達,反映審評成本上升。ANDA申請費規(guī)則費用需在提交時繳納,若申請被拒可退還75%。重提交視為申請,需再次繳費。關(guān)聯(lián)API的工廠數(shù)量影響總費用,例如某ANDA引用3個API且涉及6家工廠,需支付6倍DMF費用。DMF費用機制II類原料yaoDMF需在引用前繳費,一次性支付約(2025財年)。未繳費DMF不得用于支持ANDA,否則觸發(fā)退審。項目費分級管理根據(jù)企業(yè)獲批ANDA數(shù)量分為大、中、小型三級,2025年大型企業(yè)年費約34萬美元。附屬公司ANDA數(shù)量合并計算,繳費責(zé)任可由母公司或任一附屬公司承擔(dān)。 高新區(qū)藥品注冊eCTD性價比
- 蘇州eCTD醫(yī)療科技 2025-09-22
- 無錫電子申報eCTD性價比高 2025-09-22
- 寧波生物制品eCTD服務(wù)放心可靠 2025-09-22
- 合肥INDeCTD服務(wù)放心可靠 2025-09-22
- 楊浦區(qū)國際注冊eCTD服務(wù)商 2025-09-22
- 工業(yè)園區(qū)藥品注冊eCTD哪家好 2025-09-22
- 上海藥品注冊eCTD遞交 2025-09-22
- 寧波國內(nèi)注冊eCTD常用解決方案 2025-09-22
- 閔行區(qū)生物制品eCTD使用 2025-09-22
- 新藥eCTD服務(wù)價格 2025-09-22
- 天津數(shù)據(jù)采集器型號 2025-10-14
- 甘孜組織流程優(yōu)化工具泛微OA企業(yè)管理升級工具 2025-10-14
- 哪里智能大廈管理系統(tǒng)(IBMS)怎么看 2025-10-14
- 本地汽車裝飾用品銷售共同合作 2025-10-14
- 金山區(qū)高中雙蹤示波器 2025-10-14
- 云南電商平臺軟件開發(fā)24小時服務(wù) 2025-10-14
- 深圳大型模具制造管理系統(tǒng)生產(chǎn)管理 2025-10-14
- 工業(yè)設(shè)備數(shù)字采集供應(yīng)商 2025-10-14
- 山東全自動糖畫機品牌怎么樣 2025-10-14
- 南京科技電話交換系統(tǒng)均價 2025-10-14