江蘇內毒素檢測法規要求
來源:
發布時間:2025-10-10
隨著動物保護理念和法規要求升級,重組因子C法(rFC法)作為 LAL 法的替代技術逐漸普及。重組 C 因子是以基因重組的方式表達的 LAL 試劑中的 C 因子,C 因子被內毒素活化后切割熒光底物產生游離熒光基團,通過檢測熒光信號可以反應活化后的蛋白酶活性,并由此可以推算出內毒素的含量。與傳統 LAL 法相比,rFC 法無需依賴鱟血資源,避免了天然 LAL 試劑批間差異大、易受 β- 葡聚糖干擾等問題,且反應特異性更強。目前,《美國藥典》、《歐洲藥典》等法規已收錄 rFC 法,歐盟更推薦其用于疫苗等高風險產品檢測,在保證檢測準確性的同時,符合動物福利和可持續發展要求。
內毒素檢測需關注制劑成分,螯合劑和表面活性劑可能誘發“低內毒素回收(LER)”。江蘇內毒素檢測法規要求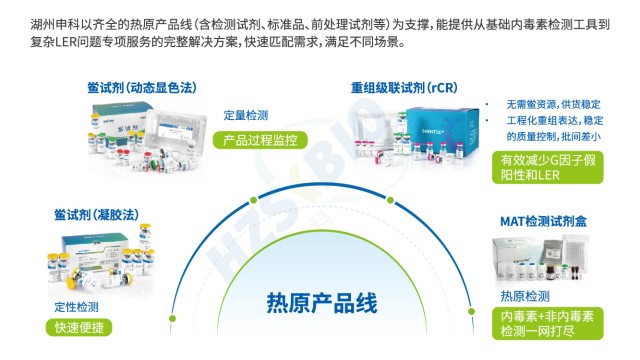
在開展內毒素檢測時,樣品的 pH 值與二價離子(Mg2?、Ca2?)水平是影響鱟試劑酶促反應的關鍵因素,直接關系檢測結果的準確性。鱟試劑檢測內毒素依賴絲氨酸蛋白酶的級聯放大反應,該反應的合適 pH 值范圍為 6.0-8.0,若樣品過酸或過堿,會快速降低酶活性,甚至導致酶徹底失活,進而出現內毒素檢測假陰性。針對這一問題,可使用 0.1N 或更低濃度的 HCl/NaOH 溶液,將樣品 pH 值準確調節至適宜區間,為反應提供穩定環境。同時,二價離子是反應必需的輔助因子:Mg2?是內毒素活化鱟試劑的關鍵,缺乏會直接阻斷反應啟動;Ca2?雖參與酶促反應,但濃度過高會反向抑制反應效率。若樣品中含有肝素鈉、EDTA、檸檬酸鈉等螯合劑,會與二價離子結合導致其濃度不足,此時可通過內毒素檢查用水稀釋樣品降低螯合劑濃度,或添加特定二價離子試劑補充,但需嚴格控制離子濃度,避免過度增強反應引發誤差,確保內毒素檢測能真實反映樣品中的內毒素殘留量。
化學制藥內毒素檢測合規申報重組級聯試劑(rCR)適用于細胞培養輔料、單抗、凍干疫苗等樣本,內毒素檢測適用范圍廣。
SHENTEK®動態顯色法鱟試劑具備多重優勢,為內毒素檢測提供解決方案。在法規遵循上,嚴格符合中國藥典(ChP)、美國藥典(USP)、歐洲藥典(EP)及日本藥典(JP)要求,確保檢測合規性,適配全球藥品監管場景。抗干擾能力突出,試劑中預先添加葡聚糖抑制成分,有效抑制非特異性反應,應對復雜基質樣品(如含多糖類的中藥制劑等)檢測時,保障結果可靠。檢測靈敏度高,線性范圍達 0.005 - 5EU/mL,可準確捕捉低濃度內毒素殘留,滿足高風險藥品(如基因治療產品、血液制品)嚴苛檢測需求。兼容性廣,能適配 MD、TECAN、Thermo、Biotech 等不同品牌酶標儀,無需因設備更換調整試劑,降低實驗室設備適配成本。使用便捷性上,試劑盒成套裝,無需額外采購其他試劑,實驗步驟簡潔,新手也易上手操作。穩定性出色,以凍干粉為主要成分,2 - 8℃條件下有效期超 2 年,減少試劑活性波動,保障批次間檢測一致性。適用領域廣,涵蓋胰島素等生物制品、血液制品、化學藥品及透析液等大多數樣本,從研發到生產全流程,為藥品、醫療器械等行業內毒素檢測筑牢質量防線,助力企業高效把控產品安全。
2024年7月26日,《美國藥典》微生物委員會正式宣布,將第<86>章“使用重組試劑的細菌內毒素測試”納入(USP-NF),該標準定于2025年5月正式生效。這一重要舉措不僅標志著細菌內毒素檢測領域從此正式邁入非動物源試劑的嶄新發展階段,更契合了全球生命科學領域遵循的3R原則(即通過非動物源技術替代動物實驗、減少實驗動物使用量、優化實驗流程以降低動物痛苦)。此前傳統細菌內毒素檢測多依賴從鱟血中提取的試劑,而鱟作為海洋瀕危“活化石”,其資源保護與檢測需求間的矛盾長期存在;如今重組級聯試劑(rCR)憑借技術創新成功替代傳統鱟血,在有效守護藍血鱟的生態未來、緩解資源依賴困境的同時,也為藥品生產中的內毒素質量控制和用藥安全保障,提供了更先進、更穩定且具備長期可持續性的解決方案。
外源性熱原含細菌內毒素、脂磷壁酸、酵母多糖等,單核細胞活化反應檢查法可檢出全部熱原。
在內毒素檢測的技術體系中,凝膠法與動態顯色法基于不同原理與特性,形成互補應用格局。凝膠法依托鱟試劑與內毒素的凝集反應,實現定性或半定量檢測,其靈敏度覆蓋 0.03EU/ml、0.06EU/ml 等多梯度,60 分鐘即可完成反應;檢測結果依賴肉眼觀察(180° 倒轉判讀凝膠形成),數據需手工記錄,配套 內毒素凝膠法測定儀(恒溫儀) 即可開展,雖自動化程度有限,但操作簡潔,適用于生產環節的快速初篩。與之相比,動態顯色法通過監測反應混合物吸光度或透光率的變化(如達預設檢測值的反應時間、信號增速)實現 定量檢測 ,靈敏度拓展至 5-0.005EU/ml ,60-90 分鐘反應時長雖略長,卻可借助酶標儀或全自動內毒素檢測分析儀完成全流程自動化操作—軟件實時采集數據,契合藥品生產質量管理規范(GMP)對數據追溯與精度的要求。二者各有側重:凝膠法以 “快速定性” 服務基礎防控,動態顯色法憑 “準確定量 + 自動化” 支撐嚴苛質控,共同為內毒素檢測提供靈活適配的技術路徑。
內毒素檢測方法多樣,影響因素及實驗干擾較多,包括實驗操作步驟、樣品處理等方面。醫療器械內毒素檢測LER現象進行重組級聯試劑時,不同酶標儀檢測樣本 Onset time 有差異,因信號采集方式和靈敏度不同。江蘇內毒素檢測法規要求
低內毒素回收(LER)又稱內毒素掩蔽,是指無菌制劑(尤其蛋白類生物制劑)進行內毒素檢測時,加標內毒素的回收率<50% 的現象,且無法通過稀釋排除,區別于傳統檢測干擾。LER 會導致內毒素污染被低估,已被全球監管機構重點關注:FDA 2013 年要求生物藥 BLA 申報時提交 LER 研究報告;EMA 2023 年明確含表面活性劑(如吐溫)或螯合劑(如 EDTA)的制劑需提供 LER 數據;中國藥典 2025 版 9251 通則也新增 LER 內容,與國際接軌。這些要求促使企業優化內毒素檢測流程,避免因 LER 導致的檢測偏差,確保藥品安全。
江蘇內毒素檢測法規要求
下一篇:
上海非動物源熱原檢測技術服務
相關新聞
- 上海熱原檢測方法驗證 2025-10-13
- 北京抗體藥物熱原檢測體系 2025-10-13
- 生物制品內毒素檢測重組級聯試劑(rCR) 2025-10-13
- 浙江合規性內毒素檢測低內毒素回收 2025-10-13
- 細菌內毒素檢測常見問題分析 2025-10-13
- 山西熱原檢測規范 2025-10-12
- 上海醫療器械熱原檢測MAT法 2025-10-12
- 江蘇合規性內毒素檢測凝膠法鱟試劑 2025-10-12
- 江蘇抗體藥物熱原檢測操作步驟 2025-10-12
- 浙江重組蛋白內毒素檢測合規申報 2025-10-12
推薦新聞
- 寧波切片有哪些 2025-10-13
- 浙江哪里有科研一抗售價 2025-10-13
- 江蘇殼聚糖傷口護理膜生產廠家 2025-10-13
- 杭州一次性醫療導管一站式制造 2025-10-13
- 上海多功能移位機價格 2025-10-13
- 江蘇傷口敷料貼源頭廠家 2025-10-13
- 北京五爪型異物鉗 2025-10-13
- 河北PLLA左旋聚乳酸需求 2025-10-13
- 陜西特色中鹽核酸酶銷售電話 2025-10-13
- 昆明超潤涂層定制 2025-10-13