江蘇高效熱原檢測法規要求
來源:
發布時間:2025-09-29
MAT 試劑盒熱原檢測配套細胞的質量控制,是保障檢測結果可靠的重要環節,需從功能、安全性、穩定性三方面建立體系。在功能鑒定上,按歐洲 MAT 法要求,需檢測細胞的 Toll 樣受體(TLR1-TLR9)表達情況—確保細胞能響應不同類型熱原(如 TLR4 響應 LPS、TLR2/6 響應脂磷壁酸);同時考察細胞倍增時間(確保活性穩定)、熱原反應性(對標準內毒素和非內毒素熱原的信號強度),確保細胞具備熱原識別與炎癥因子分泌能力。在安全性檢測上,需驗證細胞無菌(無細菌、真菌污染)、無支原體、無外源病毒因子(如 HIV、HBV)及分枝桿菌,避免外源污染影響檢測結果。在穩定性考察上,需監測不同代次細胞的熱原刺激敏感性,一般要求細胞使用代次不超過 20 代,代次過高會導致 TLR 表達下降、炎癥因子分泌減少,影響檢測靈敏度。湖州申科的配套細胞還額外通過 Western blot 驗證 TLR 受體表達量,并用不同非內毒素熱原配體刺激驗證響應性,形成全維度質量控制,確保細胞適配熱原檢測需求。
MAT 法通過熱原活化單核細胞 TLR 受體,釋放 IL-6 等細胞因子,ELISA 檢測 IL-6 推算熱原含量。江蘇高效熱原檢測法規要求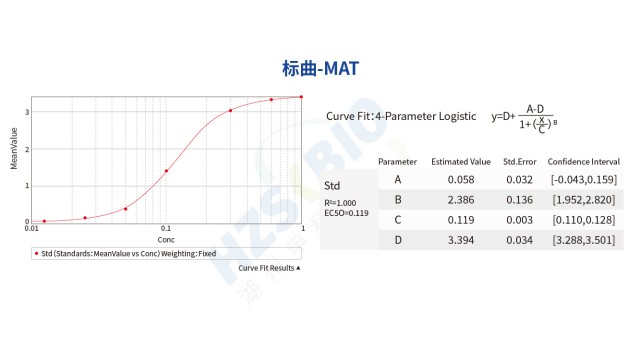
傳統細菌內毒素檢查法(BET)只能檢測革蘭氏陰性菌的 LPS,無法識別革蘭氏陽性菌 LTA、真菌酵母多糖、病毒鞭毛蛋白等非內毒素熱原,存在漏檢風險;同時,部分樣品(如脂質體、表面活性劑制劑)會因內毒素吸附導致低內毒素回收(LER),BET法難以準確定量。MAT 法通過單核細胞表面的多種 TLR 受體(TLR1-TLR10),可識別不同類型熱原:TLR4 識別 LPS、TLR2/TLR6 識別 LTA 與酵母多糖、TLR5 識別鞭毛蛋白、TLR3 識別病毒 dsRNA 等,實現 “全熱原覆蓋”。湖州申科生物熱原檢測試劑盒(MAT法)的驗證數據顯示,其對不同濃度非內毒素熱原均有響應:如 0.1-100μg/mL 鞭毛蛋白可檢測到 0.005-0.035EU/mL熱原活性,0.1-10μg/mL LTA 對應 0.1-0.7EU/mL 熱原活性,1-100μg/mL 雷西莫特(TLR7/8 配體)對應 0.5-3.0EU/mL 熱原活性。此外,MAT法檢測的是熱原的生物活性(而非單純 LPS 含量),可避免 LER 導致的假陰性,為CGT等高風險產品提供更有保障的熱原檢測方案。
北京合規性熱原檢測MAT法PyroSHENTEK 熱原檢測(MAT)試劑盒的單核細胞系無需供體,避免PBMC血源供應受限及標志物檢測環節。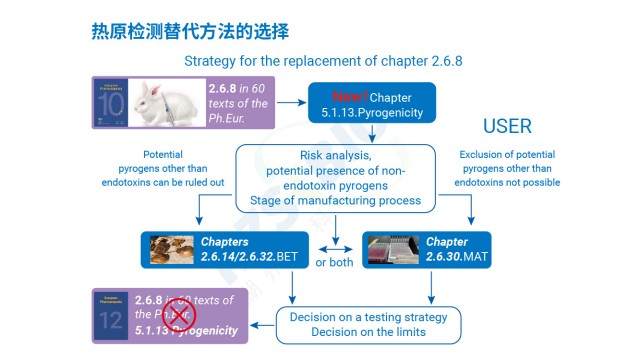
MAT 法熱原檢測標曲采用非倍比稀釋,而非 1-0.5-0.25 的倍比稀釋,主要優勢在于提升標曲準確性與適用性,避免稀釋誤差影響。一是可密集覆蓋關鍵濃度區間:熱原檢測的重點關注區為低濃度拐點(如 0.0125-0.1EU/mL)與高濃度平臺區(如 0.5-1EU/mL),非倍比稀釋可在這些區間設置更多濃度點(如 0.0125、0.025、0.05、0.1、0.25、0.5、1EU/mL),提升曲線擬合精度,而倍比稀釋低濃度點少,易導致低濃度熱原定量不準。二是降低稀釋誤差累積:倍比稀釋需連續稀釋(如 1EU/mL→0.5EU/mL→0.25EU/mL),每一步誤差會累積,導致低濃度點實際濃度偏離理論值;非倍比稀釋通過單獨配制每個濃度點(如直接用標準品配制 0.025EU/mL),避免誤差累積,提升標曲可靠性。三是適配不同樣品濃度:非倍比稀釋可根據樣品預期濃度調整標曲范圍,如樣品預期濃度 0.05EU/mL,可增加 0.025、0.05、0.1EU/mL 點,確保樣品濃度落在標曲線性區,而倍比稀釋范圍固定,靈活性差。這些優勢使非倍比稀釋成為 MAT 法標曲配制的優先選擇方式。
湖州申科生物熱原檢測(MAT法) 試劑盒在靈敏度、穩定性與適用性上表現突出,關鍵性能參數符合藥典要求:標曲線性范圍 0.0125-1.0EU/mL,相關系數 R2≥0.98,定量限 0.025EU/mL,檢測限(LOD)0.0125EU/mL,批間精密度 CV≤25%,可準確捕捉微量熱原。其優勢在于特定的單核細胞系 —— 與依賴供體血液的 PBMC 細胞不同,申科 MAT 細胞系來源清晰可溯源,無需倫理審批與血站合作,規避供體差異導致的檢測波動。對比同類型產品(如國外廠家 PBMC 細胞),申科細胞系的標曲各濃度點 CV 更低( 低至3.6%)、相對偏差更小( 12.31%),線性 R2 達 1.000,穩定性更優。此外,細胞凍存液組分經優化,復蘇后活率高,無需額外調整細胞狀態即可直接與供試品共孵育,操作便捷;且適配任何具備 450nm 波長的酶標儀,無需專門的設備,降低實驗室投入成本。
中國藥典9301已將MAT列為熱原檢測的補充方法,美國藥典鼓勵企業采用經過驗證的MAT替代家兔法。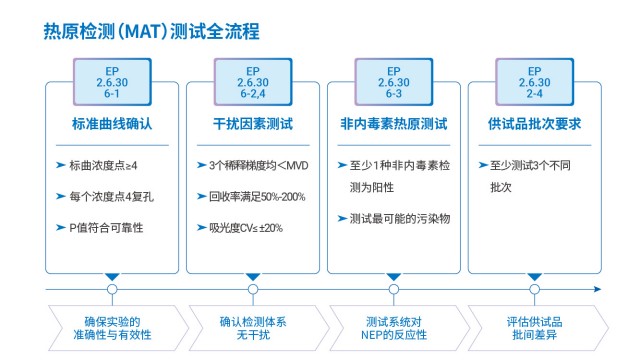
在 MAT 熱原檢測中,單核細胞系與 PBMC(外周血單個核細胞)的檢測結果穩定性差異明顯。實驗結果數據顯示,單核細胞系的標曲 R2 達 1.000,各濃度點 CV 值極低(如 ST1 為 0.92%、ST2 為 1.5%),相對偏差均在 5% 以內;而 PBMC 的標曲 R2 為 0.997,部分濃度點 CV 值超 20%(如 ST2 為 39.6%、ST6 為 45.5%),相對偏差高達 171.43%。這種差異源于兩者對熱原反應的一致性—單核細胞系能穩定釋放 IL-6,PBMC 則因供體差異導致 IL-6 釋放水平波動,直接影響熱原檢測結果的重復性,單核細胞系更適配準確的熱原定量需求。
選擇熱原檢測單核細胞活化反應測定法,即是選擇更準確、更安全、更可持續的檢測方案。上海非動物源熱原檢測MAT法細胞因子IL-6因穩定性高、半衰期長,被選為熱原檢測MAT法關鍵定量指標,優于TNF-α與IL-1β。江蘇高效熱原檢測法規要求
在單核細胞活化試驗(MAT)的熱原檢測中,IL-6 被確定為關鍵檢測指標,而非 IL-1β 或 TNF-α,主要源于其在穩定性、生物學關聯性及商業化應用上的優勢。從穩定性來看,IL-6 在體外培養環境中受個體免疫狀態影響較小,半衰期更長,實驗重復性更優,且檢測靈敏度高,能準確定量熱原污染水平;而 TNF-α 和 IL-1β 產生時間短、表達量低,還易被蛋白酶降解,導致檢測信號波動大,難以標準化。從生物學特性而言,IL-6 是先天免疫反應的炎癥介質,可通過活化 JAK-STAT 和 NF-κB 通路驅動急性期反應,如誘導大腦產生前列腺素 E2(PGE2)觸發發熱,與熱原的致熱機制直接關聯,是公認的發熱標志物。同時,MAT 法熱原檢測會輔以 IL-1β 和 TNF-α 監測 ——IL-1β 反映單核細胞活化程度,TNF-α 提示炎癥放大效應,形成多因子協同體系。此外,IL-6 的 ELISA 試劑盒市場成熟度高、跨平臺兼容性強,而 IL-1β 和 TNF-α 的檢測方法在靈敏度和標準化上仍有局限,進一步奠定了 IL-6 的重要地位。
江蘇高效熱原檢測法規要求
上一篇
浙江重組蛋白內毒素檢測風險評估
下一篇:
江蘇原料藥內毒素檢測風險評估
相關新聞
- 上海熱原檢測方法驗證 2025-10-13
- 北京抗體藥物熱原檢測體系 2025-10-13
- 上海抗體藥物內毒素檢測低內毒素回收 2025-10-13
- 江蘇原料藥熱原檢測規范 2025-10-13
- 生物制品內毒素檢測重組級聯試劑(rCR) 2025-10-13
- 浙江合規性內毒素檢測低內毒素回收 2025-10-13
- 細菌內毒素檢測常見問題分析 2025-10-13
- 山西熱原檢測規范 2025-10-12
- 上海醫療器械熱原檢測MAT法 2025-10-12
- 江蘇合規性內毒素檢測凝膠法鱟試劑 2025-10-12
推薦新聞
- 寧波切片有哪些 2025-10-13
- 浙江哪里有科研一抗售價 2025-10-13
- 江蘇殼聚糖傷口護理膜生產廠家 2025-10-13
- 杭州一次性醫療導管一站式制造 2025-10-13
- 上海多功能移位機價格 2025-10-13
- 江蘇傷口敷料貼源頭廠家 2025-10-13
- 北京五爪型異物鉗 2025-10-13
- 河北PLLA左旋聚乳酸需求 2025-10-13
- 陜西特色中鹽核酸酶銷售電話 2025-10-13
- 昆明超潤涂層定制 2025-10-13