廣東qPCR法宿主細胞殘留DNA檢測
來源:
發(fā)布時間:2025-09-27
宿主細胞殘留DNA樣本前處理試劑盒(磁珠法)機裝版,適用于生物制品樣品的前處理環(huán)節(jié),能穩(wěn)定高效獲取樣品中的微量宿主細胞DNA。該試劑盒可在細胞裂解液、澄清上清、純化中間品等多種復(fù)雜基質(zhì)緩沖液中,實現(xiàn)DNA的穩(wěn)定提取與高回收率,且適配多種基質(zhì)緩沖溶液,可有效提取純化微量DNA。此外,該試劑盒能與各類SHENTEK®宿主細胞(包括CHO、大腸桿菌E.coli、Vero、酵母、NS0、Human、MDCK、Sf9&AcNPV、Hi5&AcNPV、質(zhì)粒、SV40LTA&EIA等)DNAqPCR檢測試劑盒搭配使用。
宿主細胞殘留DNA檢測通過樣品前處理和 qPCR 檢測方法,實現(xiàn)高通量、高靈敏度、高效率和高準確性。廣東qPCR法宿主細胞殘留DNA檢測
SHENTEK®E1A殘留DNA檢測試劑盒,可定量檢測生物制品中特定宿主細胞(如HEK293、293T細胞)來源的E1A殘留DNA。該試劑盒基于熒光探針原理,通過qPCR方法定量分析樣品中的E1A殘留DNA,具備檢測快速、專一性強、性能穩(wěn)定可靠的特點。試劑盒內(nèi)配套E1A線性化定量參考品與非線性化定量參考品,供客戶根據(jù)自身需求選擇使用。本試劑盒與SHENTEK®宿主細胞殘留DNA樣本前處理試劑盒搭配使用,能準確定量樣品中殘留的微量E1A DNA。整個分析系統(tǒng)通過優(yōu)化前處理與檢測步驟的兼容性,有效提升對E1A相關(guān)微量DNA殘留的回收率及定量準確度。
山西MDCK宿主細胞殘留DNA檢測銷售廠家宿主細胞殘留DNA檢測體系的穩(wěn)定性依賴于參考品標定和試劑批間差異控制。
SHENTEK® CHO 殘留 DNA 檢測試劑盒,可對各類生物制品及藥品的中間品、半成品與成品中殘留的 CHO 宿主細胞 DNA 進行定量檢測。該試劑盒基于熒光探針原理實現(xiàn)對樣品中 CHO 殘留 DNA 的定量,不僅檢測高效快速、專一性突出、性能穩(wěn)定可靠,檢測限還能達到 fg 級別。試劑盒配套提供 CHO DNA 定量參考品,且該參考品已通過嚴格溯源至國家標準品,能有效保障檢測結(jié)果的準確性與可追溯性。該試劑盒與 SHENTEK® 宿主細胞殘留 DNA 樣本前處理試劑盒搭配使用,能夠準確定量樣品中殘留的微量 CHO 細胞 DNA。
SHENTEK® Sf9&AcNPV 殘留 DNA 檢測試劑盒(多重 PCR - 熒光探針法),可對昆蟲細胞(Sf9)桿狀病毒表達系統(tǒng)所生產(chǎn)的基因工程疫苗中,殘留的 Sf9 細胞 DNA 與桿狀病毒(AcNPV)DNA 進行定量檢測。該試劑盒依托 Taqman 探針原理,結(jié)合多重 qPCR 技術(shù)實現(xiàn)對樣品中 Sf9 及 AcNPV 殘留 DNA 的定量,不僅檢測效率高、專一性突出,且性能穩(wěn)定可靠,檢測限可達到 50 copies / 反應(yīng),試劑盒還配套提供 Sf9&AcNPV 定量參考品。此試劑盒與 SHENTEK® 宿主細胞殘留 DNA 樣本前處理試劑盒搭配使用,能夠準確定量樣品中殘留的 Sf9&AcNPV 微量 DNA,保障檢測結(jié)果的準確性與可靠性。
宿主細胞殘留 DNA 檢測需準確把控靶標序列從而保障檢測針對性。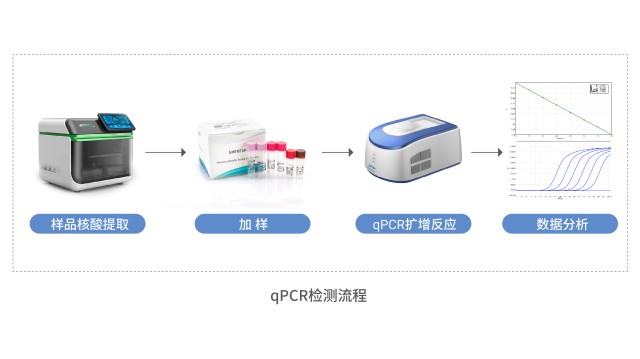
宿主細胞殘留DNA檢測中若回收率不達標,可依照以下思路排查。首先查看PCS/NCS,確認PCS回收率是否合格、計算公式是否無誤,同時檢查NCS質(zhì)控是否達標。隨后排查試劑與耗材,核實洗滌液B是否過期或配制有誤,異丙醇是否符合分析純標準,常溫試劑是否出現(xiàn)結(jié)晶,試劑儲存溫度是否恰當,以及磁珠是否難以重懸。再聚焦樣品情況,確認樣品殘留量與加標量是否適宜,pH值是否存在異常,以及是否含有抑制因子干擾磁珠功能與PCR實驗。完成上述排查后,再審視操作流程,檢查樣品是否徹底消化、消化后狀態(tài)是否呈可流動狀,磁珠是否復(fù)溫,洗滌與洗脫過程中磁珠狀態(tài)如何、是否被誤棄,以及洗脫前磁珠是否過度干燥等。
實時定量PCR(qPCR)憑借高靈敏度和特異性,成為宿主細胞殘留DNA檢測的主流方法。河北CHO宿主細胞殘留DNA檢測常見問題市場上已有常用宿主細胞殘留DNA檢測試劑盒,建議用戶選擇采用性能穩(wěn)定且經(jīng)過驗證的試劑盒。廣東qPCR法宿主細胞殘留DNA檢測
更換宿主細胞殘留DNA(HCD)檢測試劑盒時,需開展一系列驗證相關(guān)考量。首先參照《已上市生物制品藥學變更研究技術(shù)指導(dǎo)原則(試行)》,根據(jù)變更對生物制品安全性、有效性及質(zhì)量可控性的風險影響程度分類,實施變更前需開展充分研究與驗證。其次進行全面性能驗證,采用藥典方法或已驗證的檢測方法,證明變更后分析方法與原方法等效或更優(yōu)。隨后開展樣品檢驗,對比試劑盒更換前后的產(chǎn)品質(zhì)量數(shù)據(jù)并綜合評估,結(jié)合穩(wěn)定性研究進行穩(wěn)定性可比性分析,檢測細微差異以評價變更對產(chǎn)品質(zhì)量的影響。完成上述步驟后,再辦理試劑盒更換備案;若變更后方法與原方法相當或更優(yōu),根據(jù)待檢樣品為原液或制劑,將變更歸為中等或微小變更,微小變更可在中等變更申請中一并說明。
廣東qPCR法宿主細胞殘留DNA檢測
相關(guān)新聞
- 北京疫苗熱原檢測流程 2025-10-13
- 上海熱原檢測方法驗證 2025-10-13
- 浙江重組蛋白內(nèi)毒素檢測鱟試劑 2025-10-13
- 湖南熱原檢測體系 2025-10-13
- 北京抗體藥物熱原檢測體系 2025-10-13
- 上海抗體藥物內(nèi)毒素檢測低內(nèi)毒素回收 2025-10-13
- 江蘇原料藥熱原檢測規(guī)范 2025-10-13
- 生物制品內(nèi)毒素檢測重組級聯(lián)試劑(rCR) 2025-10-13
- 湖北非動物源熱原檢測 2025-10-13
- 重慶熱原檢測方法驗證 2025-10-13
推薦新聞
- 閔行區(qū)是什么醫(yī)療管理服務(wù)招商 2025-10-13
- 高新區(qū)高韌性尼龍專賣店 2025-10-13
- 福建進口成型片廠家 2025-10-13
- 湖州小腿裝智能假肢哪家便宜 2025-10-13
- 蘇州一次性手術(shù)器械EO滅菌服務(wù)商 2025-10-13
- 北京安全益生元供應(yīng) 2025-10-13
- 天津誘導(dǎo)多能干細胞重組層粘連蛋白Biolaminin521節(jié)省成本 2025-10-13
- 嘉興小腿智能假肢廠家 2025-10-13
- 新疆全國連鎖美容院射頻美容儀常見問題 2025-10-13
- 寶安區(qū)推薦體外診斷試劑銷售廠家 2025-10-13