中國香港腦組織全景掃描大概多少錢
0. 分子生物學研究中,全景掃描技術可結合熒光原位雜交與超高分辨率成像,對細胞內的 DNA、RNA 分子進行全域定位與動態追蹤,清晰呈現染色體的空間結構、基因的表達位置及 RNA 的轉運路徑。通過分析這些分子的空間排布與相互作用,揭示基因調控網絡的時空動態,例如在研究基因表達調控時,全景掃描發現了特定轉錄因子與基因啟動子的結合位置及結合強度隨細胞周期的變化,為理解基因表達的精確調控機制提供了直接證據,也為基因編輯技術的優化提供了參考。對極地苔原植被全景掃描,評估氣候變暖對其覆蓋度的影響。中國香港腦組織全景掃描大概多少錢
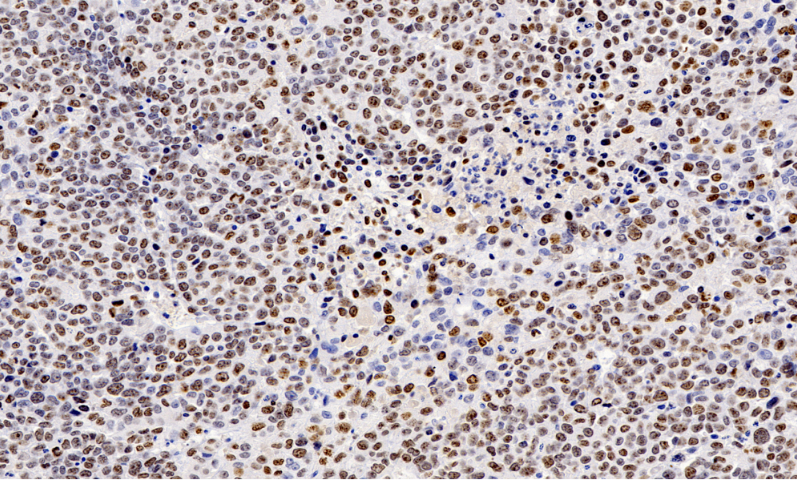
結合穩定同位素示蹤技術,全景掃描進一步闡明了土壤團聚體 對碳封存的影響:微團聚體(<250μm)通過物理保護作用減緩有機碳的微生物降解,而大團聚體的形成則依賴于***菌絲和根系分泌物的膠結作用。這些發現為可持續農業 提供了重要依據,例如通過調整耕作方式優化孔隙結構,或接種特定微生物群落增強土壤肥力。此外,在污染土壤修復 領域,全景掃描揭示了污染物(如重金屬、微塑料)在孔隙中的遷移規律,為開發靶向生物修復 策略奠定了基礎。未來,結合人工智能圖像分析,該技術有望在土壤碳匯評估和氣候變化應對中發揮更大作用。新疆Masson全景掃描單價全景掃描監測葉片衰老,記錄葉綠素降解與細胞結構解體的順序。
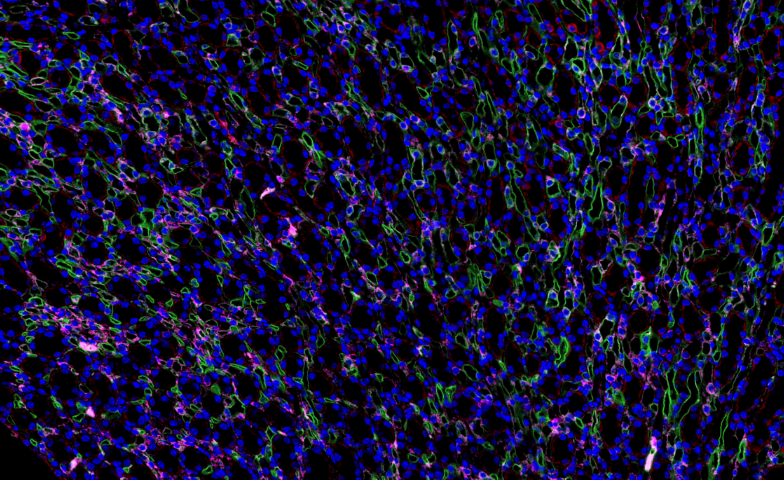
在再生生物學研究中,全景掃描技術實現了對生物體損傷修復過程的動態、多尺度觀測。通過高分辨率***成像和三維重構技術,研究者能夠精確追蹤再生過程中細胞的遷移路徑(如干細胞向損傷位點的定向募集)、增殖熱點(如芽基組織的形成)以及分化軌跡(如軟骨、肌肉和神經的同步再生)。以蠑螈肢體再生為例,全景掃描結合熒光標記技術清晰呈現了損傷后24小時內表皮細胞的快速覆蓋、72小時后多能干細胞的聚集,以及后續的空間有序分化——外層形成軟骨模板,內部肌纖維再生,同時伴隨血管和神經的精細延伸。結合單細胞轉錄組測序,研究發現FGF10、BMP2等基因在再生不同階段呈現動態表達,調控細胞命運決定。此外,全景掃描還揭示了細胞外基質(ECM)重塑對再生微環境的關鍵作用,如膠原纖維的定向排列引導組織形態發生。這些發現為人類再生醫學提供了重要啟示,例如通過模擬蠑螈的ECM動態變化,可優化生物支架材料的設計,促進慢性傷口愈合;而干細胞時空***策略則可能應用于***體外再生,減少移植排斥風險。未來,結合人工智能動態建模,全景掃描技術有望在再生醫學領域實現更精細的調控,推動創傷修復和退行性疾病***的發展。
0. 寄生蟲學研究運用全景掃描技術觀察寄生蟲的生活史及與宿主的相互作用,通過高分辨率成像追蹤寄生蟲從卵到成蟲的發育過程,記錄其在宿主體內的遷移路徑及對宿主組織的侵襲方式。結合分子檢測技術,分析寄生蟲分泌的效應分子對宿主免疫反應的調控機制,例如在瘧原蟲研究中,全景掃描清晰展示了瘧原蟲在紅細胞內的繁殖過程及對紅細胞結構的破壞,為抗瘧藥物的研發提供了靶點,同時也有助于理解瘧疾的傳播機制,為制定防控策略提供科學依據。利用全景掃描研究蜘蛛結網,分析絲線分泌與網結構構建的關系。
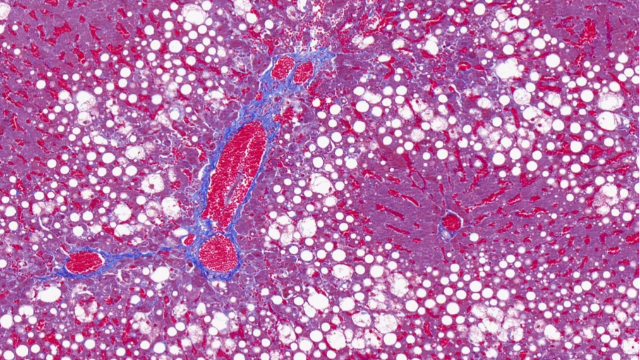
在軟骨組織工程研究中,全景掃描技術已成為評估工程化軟骨構建質量的金標準。該技術通過多尺度成像系統實現了對軟骨再生全過程的動態監控,具體包括:①微米CT(μ-CT)定量分析PCL/膠原復合支架的孔隙連通性(比較好孔徑150-300μm);②雙光子顯微鏡***追蹤MSCs細胞在支架內的遷移路徑與分化軌跡(SOX9、COL2A1表達);③拉曼光譜成像無標記檢測GAGs和II型膠原的空間沉積規律。***研究表明,通過時間序列全景掃描發現:當支架降解速率(如PLGA)與軟骨基質分泌速率達到1:1.2時,可形成比較好的力學性能(壓縮模量≥0.8MPa)。這一發現直接優化了"梯度降解支架"的設計——表層快速降解誘導細胞增殖,**層緩釋TGF-β3促進分化。在臨床轉化中,結合AI圖像分析算法的全景掃描系統,可自動識別工程化軟骨的纖維化區域(COLI/II比值>0.3),使產品質量控制效率提升5倍。目前,該技術已成功應用于耳廓再生和關節軟骨修復,患者術后1年的T2-mapping磁共振顯示,新生軟骨與天然軟骨的各向異性指數差異<15%。未來,整合力學-化學耦合全景掃描的新一代評估平臺,將進一步推動個性化軟骨組織工程產品的臨床應用。
全景掃描觀察骨髓造血,呈現造血干細胞分化為各類血細胞的過程。新疆Masson全景掃描單價
對苔蘚植物群落全景掃描,探究其在巖石表面的定植與土壤形成。中國香港腦組織全景掃描大概多少錢
細胞自噬研究中,全景掃描技術的應用極大地推動了該領域的動態監測能力。通過高分辨率熒光標記技術,研究人員能夠實時追蹤自噬相關蛋白(如LC3、p62等)的時空分布,精確記錄自噬體從起始、擴展、成熟到與溶酶體融合的全過程。結合高速成像和三維重構技術,可量化分析自噬體在細胞內的運動速率、軌跡特征及數量波動。蛋白質組學數據的整合進一步揭示了關鍵調控節點:在營養缺乏時,mTOR信號通路抑制誘導自噬***;氧化應激條件下,AMPK和FOXO通路調控自噬體形成。值得注意的是,在**微環境中,全景掃描發現自噬體在*細胞的核周區域異常聚集,這種空間分布紊亂與溶酶體酸化障礙相關,導致化療藥物無法被有效降解而形成耐藥性。基于這些發現,研究者已開發出靶向自噬體-溶酶體融合環節的抑制劑(如羥氯喹),并在臨床試驗中驗證其可增強傳統化療效果。這些成果不僅為*****提供了新策略,更完善了對自噬在細胞代謝重編程、受損細胞器***等穩態維持機制中的系統性認知。中國香港腦組織全景掃描大概多少錢
- 浙江哪里有科研一抗售價 2025-10-13
- 遼寧熒光三標全景掃描售價 2025-10-13
- 新疆ELISA試劑盒常見問題 2025-10-13
- 中國澳門動物試驗ELISA試劑盒歡迎選購 2025-10-12
- 湖北全景掃描 2025-10-12
- 寧夏大鼠科研一抗咨詢報價 2025-10-12
- 西藏試驗室ELISA抗體試劑一般多少錢 2025-10-12
- 陜西哪里有ELISA試劑盒售價 2025-10-12
- 重慶推薦ELISA抗體試劑咨詢報價 2025-10-12
- 中國臺灣魚ELISA試劑盒歡迎選購 2025-10-12
- 黃浦區按需求紅外線腔體影像檢查儀銷售電話 2025-10-13
- 遼寧質量中鹽核酸酶量大優惠 2025-10-13
- 蘇州一次性醫療耗材開發哪家好 2025-10-13
- 云南比較好的肺纖維化模型有哪些 2025-10-13
- 上海溫室群體光合儀報價 2025-10-13
- 醫療物聯網智護安全一體化管理平臺行業頭部公司 2025-10-13
- 背部矯正器支具 2025-10-13
- 楊浦區進口醫療器械批發 2025-10-13
- 寧夏好的病理切片石蠟批發廠家 2025-10-13
- 湖南玻璃儀器產業鏈 2025-10-13