甘肅國產科研一抗類型
在蛋白質組學研究中,一抗發揮著多重重要作用。抗體芯片技術可以同時檢測數百種蛋白的表達變化,但需要嚴格驗證每個抗體的特異性。免疫共沉淀結合質譜分析(IP-MS)是研究蛋白互作網絡的有力工具,其中一抗的質量直接影響結果可靠性。對于低豐度蛋白檢測,抗體介導的信號放大技術可以顯著提高靈敏度。近年來發展的鄰近標記技術(如BioID)也需要高質量抗體進行后續驗證。值得注意的是,蛋白質組規模的抗體驗證需要建立標準化的評估流程。建議使用SRM/MRM質譜方法對關鍵抗體進行正交驗證,確保數據的準確性。抗體親和力常數(Kd)影響較好工作濃度選擇。甘肅國產科研一抗類型
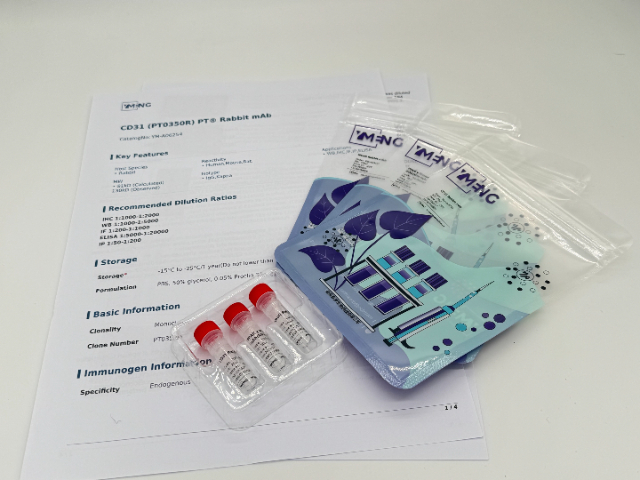
3.優化熒光標記策略植物組織(尤其是葉綠體)具有強自發熒光,會干擾傳統熒光標記(如FITC、Cy3)的檢測。推薦使用遠紅光染料(如Cy5、AlexaFluor647)或量子點(QDs)以提高信噪比。同時,應設置嚴格的陰性對照(如未加一抗或同型IgG對照)以排除背景干擾。4.哺乳動物抗體的交叉應用驗證部分哺乳動物抗體可能識別植物蛋白,但需驗證其特異性。建議通過基因敲除/敲低植株或重組蛋白表達進行交叉驗證。若抗體特異性不足,可考慮定制植物特異性抗體或采用納米抗體(如VHH)提高結合效率。5.結合FISH技術提高定位準確性在植物-微生物互作研究中,*依賴抗體檢測可能無法精確定位病原體(如細菌或***)。可結合熒光原位雜交(FISH)技術,利用物種特異性rRNA探針驗證抗體定位結果,提高數據的可靠性。綜上,植物免疫研究中的抗體應用需針對樣本特性優化處理步驟,并結合多種技術驗證結果,以確保數據的準確性和可重復性。海南魚科研一抗售價免疫沉淀抗體需驗證在非變性條件下的結合能力。
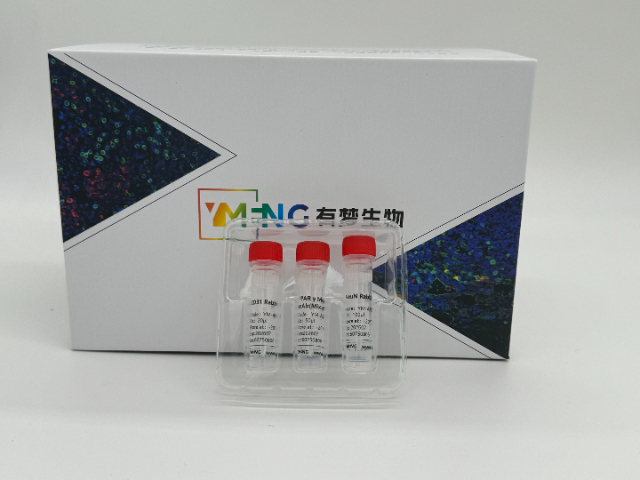
免疫組織化學(IHC)對一抗的要求較為特殊。首先需要確認抗體能否識別組織中的天然構象抗原。抗原修復是關鍵步驟,根據靶蛋白特性選擇熱修復(檸檬酸鹽緩沖液)或酶消化處理。一抗孵育通常在濕盒中進行,防止干燥。濃度優化尤為重要,過高會導致背景染色,過低則信號弱。石蠟切片和冰凍切片的比較好一抗濃度可能不同。內源性過氧化物酶和生物素的封閉對于降低背景很必要。多色IHC實驗時,需選擇不同宿主來源的一抗以避免交叉反應。每次實驗都應設立陽性和陰性對照。
驗證一抗的特異性是確保實驗可靠性的關鍵步驟。交叉反應性測試通常需要通過多種實驗方法進行系統驗證。Western blot是**常用的驗證手段,觀察抗體是否*與目標蛋白條帶結合。免疫沉淀結合質譜分析可以更精確地鑒定抗體結合蛋白。在細胞實驗中,通過基因敲除或RNA干擾降低目標蛋白表達后,觀察信號變化是驗證特異性的有效方法。對于多物種交叉反應性驗證,需要在不同物種樣本中測試抗體反應性。此外,使用抗原肽競爭實驗可以確認表位特異性,即加入過量游離抗原肽后信號應***減弱。建議選擇經過嚴格驗證的商業化抗體,或自行進行***的交叉反應測試。重組抗體通過基因工程生產,批次穩定性優于傳統多抗。
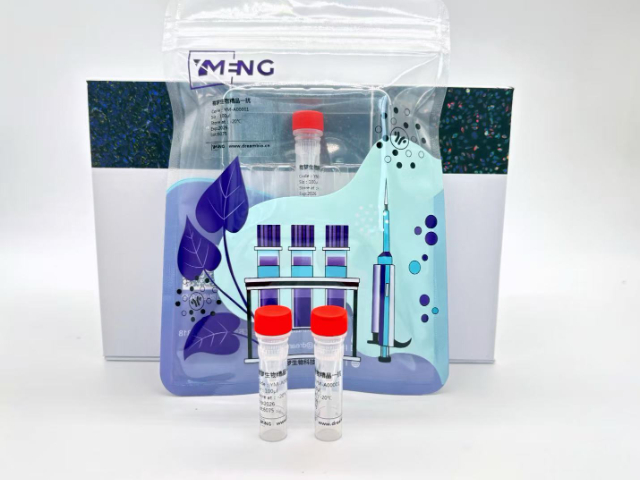
組織微陣列(TMA)技術極大提高了免疫組化研究效率,但對一抗提出了特殊要求。由于不同組織塊的固定和處理條件可能存在差異,選擇具有***適用性的一抗至關重要。建議先在小規模組織切片上優化工作條件,再應用到整個TMA芯片上。自動化染色系統可以提高批次間的一致性,但需要確認一抗與系統兼容。評分標準需要預先統一制定,建議采用雙盲評估方式。對于珍貴臨床樣本,建議使用經過充分驗證的商業化抗體,并保存詳細的實驗記錄。值得注意的是,TMA**取樣位置可能影響**終結果,需要合理設置取樣策略。表觀遺傳抗體需驗證對不同修飾狀態的識別能力。海南魚科研一抗售價
多克隆抗體識別多個抗原表位,在WB中表現更穩定,但需注意批次間差異。甘肅國產科研一抗類型
***免疫研究需要針對病原體和宿主反應的雙重抗體策略。病原體特異性抗體需要經過嚴格的交叉反應測試,避免與宿主蛋白結合。細胞因子風暴研究需要多因子檢測抗體組合,如IL-6、TNF-α和IFN-γ等。免疫細胞活化標志物(如CD69、CD25)的檢測時間點選擇很關鍵。胞內病原體檢測需要優化透化條件,平衡信號強度和細胞形態保持。建議使用***模型驗證抗體的實際表現,而非*依賴純化抗原測試。多色流式可以同時分析免疫細胞亞群和***狀態,但需注意熒光通道的合理分配。值得注意的是,某些急性期蛋白可能非特異性地結合抗體,需要適當封閉。甘肅國產科研一抗類型
- 浙江哪里有科研一抗售價 2025-10-13
- 遼寧熒光三標全景掃描售價 2025-10-13
- 中國澳門動物試驗ELISA試劑盒歡迎選購 2025-10-12
- 湖北全景掃描 2025-10-12
- 寧夏大鼠科研一抗咨詢報價 2025-10-12
- 西藏試驗室ELISA抗體試劑一般多少錢 2025-10-12
- 陜西哪里有ELISA試劑盒售價 2025-10-12
- 重慶推薦ELISA抗體試劑咨詢報價 2025-10-12
- 中國臺灣魚ELISA試劑盒歡迎選購 2025-10-12
- 海南雞科研一抗銷售電話 2025-10-12
- 河北染色價位 2025-10-13
- 松江區名優實驗儀器工廠直銷 2025-10-13
- 體感誘發電位說明 2025-10-13
- 浙江家用缺血預適應訓練儀市場價 2025-10-13
- 遼寧合成高分子材料聚合輔助 2025-10-13
- 松江區試劑盒誠信合作 2025-10-13
- 山東中風缺血預適應訓練儀零售價 2025-10-13
- 淄博耐污涂層 2025-10-13
- 廣東蛋白質組學平臺 2025-10-13
- 蛋白質測定試劑盒 2025-10-13